?此前,“袁來(lái)如此”專欄根據(jù)已發(fā)表的文獻(xiàn)資料,對(duì)PK定量方法的設(shè)計(jì)作初步介紹(袁來(lái)如此 | 大分子生物分析概論(十四_上):LBA定量分析雙特異性生物藥的挑戰(zhàn))�����。本期將延續(xù)上期內(nèi)容��,重點(diǎn)就相關(guān)案例分析��、復(fù)雜藥物分子的未來(lái)生物分析技術(shù)以及前景等方面進(jìn)行探討���。
“袁來(lái)如此”專欄系廣州博濟(jì)醫(yī)藥微信公眾號(hào)打造的科普學(xué)術(shù)專欄�����,內(nèi)容均為博濟(jì)醫(yī)藥藥物研究中心資深科學(xué)顧問(wèn)袁智博士原創(chuàng)��。
案例分析(Case studies)
以下案例研究是為了說(shuō)明對(duì)于雙特異性分子而言�,生物分析的獨(dú)特考慮,其適用于在藥物開(kāi)發(fā)的不同階段設(shè)計(jì)和實(shí)施定量生物分析和PK評(píng)估�。
案例分析1:在非臨床研究中定量總和完整雙特異性藥物并評(píng)估ADA對(duì)PK的影響。
化合物X是一種基于支架的針對(duì)兩種細(xì)胞因子的雙特異性抗體����。初步數(shù)據(jù)表明,這種特殊的支架產(chǎn)品平臺(tái)可以在非臨床物種中高頻率地誘導(dǎo)免疫原性����。為了更好地解釋ADAs存在時(shí)的毒理學(xué)發(fā)現(xiàn),生物分析小組決定開(kāi)發(fā)兩種不同的PK方法來(lái)測(cè)定動(dòng)物血清中的總藥物和完整藥物的濃度�����。總PK方法是使用兩種抗體對(duì)支架的框架進(jìn)行分析����。完整的PK方法是使用一種靶向細(xì)胞因子作為捕獲試劑,另一種作為檢測(cè)試劑??梢杂^察到�,使用兩種PK方法分析相同的樣品產(chǎn)生的濃度與時(shí)間關(guān)系幾乎完全等同�,除了在較晚的時(shí)間點(diǎn)之外���,藥物濃度非常低的時(shí)候��,即完整藥物濃度略低于總藥物濃度的時(shí)候�。
在這些時(shí)間點(diǎn)觀察到的低濃度差異只發(fā)生在少數(shù)受試者上。因此����,ADA和生物轉(zhuǎn)化(biotransformation)被認(rèn)為是最可能的根本原因。需進(jìn)行一項(xiàng)研究以確定這種差異的根本原因�����,如生物轉(zhuǎn)化誘導(dǎo)的不穩(wěn)定性�,靶標(biāo)干擾(target interference)和ADA干擾。為了驗(yàn)證這種雙特異性分子的體內(nèi)生物轉(zhuǎn)化�����,例如,蛋白質(zhì)水解是否揭示了影響穩(wěn)定性的結(jié)構(gòu)缺陷����,故開(kāi)發(fā)了兩種配體結(jié)合質(zhì)譜(ligand-binding mass spectrometry,LBMS)方法����,使用抗人Fc免疫親和捕獲和靶目標(biāo)捕獲,然后進(jìn)行分層次的質(zhì)譜分析����。采用與ESI-MS相結(jié)合的納米級(jí)液相色譜法對(duì)非多種代謝產(chǎn)物進(jìn)行了更高分辨率的分離和鑒定。
數(shù)據(jù)顯示��,生物轉(zhuǎn)化的結(jié)果為陰性���。ADA分析表明雙特異性分子比其母體藥物的ADA出現(xiàn)頻率更高�。盡管隨后通過(guò)免疫原性表征�����,證實(shí)大多數(shù)ADAs并非中和性ADAs�����,但發(fā)現(xiàn)ADAs有助于快速地清除完整藥物��。這些數(shù)據(jù)也可以解釋為當(dāng)藥物濃度足夠低時(shí)���,內(nèi)源性細(xì)胞因子占據(jù)了特定的捕獲/檢測(cè)位點(diǎn)����,即存在靶標(biāo)干擾����。結(jié)果表明,該藥物在體內(nèi)結(jié)構(gòu)穩(wěn)定��。PK數(shù)據(jù)差異與完整藥物的不穩(wěn)定性無(wú)關(guān)�����,而更可能是由于ADAs高水平導(dǎo)致清除藥物的速度更快���。
案例分析2:一個(gè)F(ab’)2在體內(nèi)生物轉(zhuǎn)化為兩個(gè)活性F(ab)單體的PK分析���。
本案例研究涉及一個(gè)雙特異性F(ab’)2,由一個(gè)anti-VEGF arm和一個(gè)anti-Ang2 arm組成,用于玻璃體內(nèi)注射(intravitreal administration)治療視網(wǎng)膜變性疾病��,如濕性老年性黃斑變性和糖尿病性黃斑水腫����。據(jù)報(bào)道,針對(duì)F(ab’)2抗體鉸鏈區(qū)的�����,先前存在的內(nèi)源性抗體(PEA)存在于很大比例的人群中�����。在未接受藥物的食蟹猴和人血清樣本中��,都證實(shí)了這一點(diǎn)�����。移除這些預(yù)先存在的內(nèi)源性抗體的鉸鏈表位(hinge epitopes)使得該分子中只有單個(gè)二硫鍵將兩個(gè)fab結(jié)合在一起��。
因此���,注射入玻璃體(其含有g(shù)lutathione作為抗氧化產(chǎn)品的一部分����,以保證晶狀體的完整性)后�,藥物分子生物轉(zhuǎn)化為individual Fabs,相關(guān)清除率(t1/2 <1天)�,通常比兔玻璃體的Fab (t1/2 約3天)或F(ab’)2 (t1/2 約3天)的清除率要大(未發(fā)表的觀察結(jié)果)。
備注:一般情況下���,t1/2與清除率的關(guān)系如下���,即半衰期還取決于藥物分布體積;如果假設(shè)分布體積恒定����,則t1/2與清除率之間的關(guān)系是確定成反比的:

因此,完整的F(ab’)2和individual Fab碎片均存在于眼腔(玻璃體和水相之中)和系統(tǒng)循環(huán)之中��。正如所預(yù)料的��,嚙齒類動(dòng)物脈絡(luò)膜新生血管模型(rodent choroidal neovascularization models)顯示�����,individual Fabs保留了生物活性�。為了全面地描述活性藥物暴露量的特征���,有必要定量這3種藥物形式。因此����,開(kāi)發(fā)并驗(yàn)證了3種單獨(dú)的PK定量方法。此前有學(xué)者曾經(jīng)考慮過(guò)使用一種總PK定量方法來(lái)測(cè)定所有這3種形式����。但是,該分子是一個(gè)新穎結(jié)構(gòu)���,故有必要闡明其生物轉(zhuǎn)化的動(dòng)力學(xué)���,這對(duì)于描述該分子體內(nèi)的行為是很重要的。
定量完整待測(cè)物的ELISA方法使用固定的(immobilized)重組蛋白Ang2捕獲待測(cè)物���,然后加入biotin-VEGF�����,最后加入streptavidin-HRP���,是一個(gè)sequential sandwich格式�。外加待測(cè)物的回收率實(shí)驗(yàn)證明這種測(cè)試格式僅能夠特異性地檢測(cè)F(ab’)2�,但檢測(cè)不到兩種Fab分子中的任何一個(gè)。定量?jī)蓚€(gè)Fab分子的方法都采納類似的基本格式:使用各自的靶標(biāo)-Ang2或靶標(biāo)-VEGF�,從樣本中捕獲Fabs。然后加入biotin-sheep antihuman IgG的重鏈和輕鏈(H&L)��,最后��,加入streptavidin-HRP進(jìn)行檢測(cè)�。
值得注意的是���,采用測(cè)定Fab的格式�,也可以檢測(cè)到完整分子�。盡管使用Fabs作為標(biāo)準(zhǔn)品(standards)和對(duì)照品(controls),在分析Fab時(shí)�����,也定量了完整F(ab’)2���。此外�����,使用F(ab’)2和任何一個(gè)Fab的混合物��,可以通過(guò)從完整分子(高特異性)的定量結(jié)果中減去Fab結(jié)果來(lái)定量另一個(gè)Fab����。已經(jīng)驗(yàn)證了所有這些分析方法,并用于兔血清樣本的非臨床研究�����,也認(rèn)證了這些方法可用于食蟹猴的血清和水/玻璃體/視網(wǎng)膜的萃取物中藥物的定量����。血清定量分析的另一個(gè)挑戰(zhàn)是幾個(gè)ng/ml甚至更低的藥物濃度,這也是玻璃體腔生物藥給藥的一致特點(diǎn):給藥量很小(通常是<1 mg/eye)�;藥物在到達(dá)系統(tǒng)循環(huán)時(shí),經(jīng)歷了高倍數(shù)的稀釋��。
案例分析3:在非臨床研究中監(jiān)測(cè)體內(nèi)雙特異性藥物生物轉(zhuǎn)化的總和活性(total and active)藥物的定量��。
一個(gè)針對(duì)腫瘤適應(yīng)癥的雙特異性單克隆抗體靶向兩個(gè)細(xì)胞表面的抗原��,其藥理作用取決于單克隆抗體的兩個(gè)結(jié)合臂(both binding arms)的完整��。然而����,在體外生物物理表征過(guò)程中��,在其中一個(gè)結(jié)合臂中發(fā)現(xiàn)了翻譯后修飾(post-translational modification����,PTM)的問(wèn)題�����。但這種PTM��,不能在不顯著損害生物活性的情況下�,通過(guò)蛋白質(zhì)工程而排除���,因?yàn)樵诓环€(wěn)定的氨基酸上的點(diǎn)突變(point mutation)會(huì)完全破壞單抗與靶標(biāo)的結(jié)合����。此外���,僅具有第二個(gè)結(jié)合臂功能的藥物變異體的累積�,可能會(huì)屏蔽活性藥物結(jié)合第二個(gè)靶點(diǎn)����,并可能在多次給藥后誘發(fā)毒性反應(yīng)����。
對(duì)該單抗體內(nèi)生物轉(zhuǎn)化的特征進(jìn)行研究是勢(shì)在必行的���,如轉(zhuǎn)化的動(dòng)力學(xué)和程度����,這可以為進(jìn)一步開(kāi)發(fā)該單抗提供指導(dǎo)�。隨后,使用與分子的Fc部分特異性結(jié)合的測(cè)試試劑開(kāi)發(fā)了一個(gè)橋接格式的總藥物PK定量方法�����,輔之以一種活性藥物PK定量方法:即使用靶標(biāo)蛋白作為PTM-liable functional domain的捕獲試劑��,使用抗人Fc試劑作為檢測(cè)試劑。利用野生型和擁有點(diǎn)突變的藥物的混合比例,活性PK方法���,在總藥物存在的情況下��,能夠區(qū)分和準(zhǔn)確測(cè)定活性藥物的百分比。之后�,評(píng)估了該藥物分子在食蟹猴上的PK特性。使用了總和活性PK定量方法來(lái)測(cè)定研究樣本中總和活性藥物的濃度����。實(shí)驗(yàn)數(shù)據(jù)證實(shí),體內(nèi)樣品中的藥物出現(xiàn)了PTM��,并且活性藥物濃度百分比隨時(shí)間而降低�。基于建模和仿真�����,可以在臨床研究中減少劑量間隔來(lái)減輕活性藥物濃度的降低���。非臨床研究結(jié)果有助于決定使用活性PK定量方法作為支持臨床研究的主要方法。而在FIH研究中�����,總PK定量方法可用于進(jìn)一步描述無(wú)活性藥物變異體(inactive drug variants)潛在的累積及其對(duì)PK/PD和毒性的影響���。
復(fù)雜藥物分子的未來(lái)生物分析技術(shù)
如表1中所總結(jié)的���,一般需要多種PK定量方法和ADA方法評(píng)估ADC和雙特異性抗體的基礎(chǔ)藥代動(dòng)力學(xué)和免疫原性�����。分析方法數(shù)量的增加給樣本的收集����、儲(chǔ)存���、運(yùn)輸����、分析和分析方法的生命周期管理帶來(lái)了巨大的負(fù)擔(dān)�。在某些情況下,由于樣本數(shù)量有限�,根本不可能進(jìn)行多次分析。對(duì)于增加的功能域和潛在的生物轉(zhuǎn)化��,僅僅增加分析方法的數(shù)量以滿足生物分析需求似乎是一個(gè)直接的解決方案���,但“兩點(diǎn)式two-point”結(jié)合方法(如夾心式LBA)并不適合評(píng)估具有多域(>3)構(gòu)造的分子“完整性intactness”�。盡管免疫捕獲(IC-)-LC-MS/MS方法在理論上可以識(shí)別來(lái)自多個(gè)功能域的特征肽���,但有關(guān)“完整性”和功能的信息仍然缺失��。因此�,隨著復(fù)雜藥物模式(complex drug modalities)的生物轉(zhuǎn)化越來(lái)越受到的關(guān)注,定量LBA方法和(IC-)LC-MS/MS方法往往無(wú)法對(duì)潛在的生物轉(zhuǎn)化提供相關(guān)信息����。正如CovX-Body和基于框架(scaffold-based)的雙特異性抗體的案例所表明的那樣,PK行為的意外不一致觸發(fā)了潛在生物轉(zhuǎn)化的嫌疑���,進(jìn)而就需要新的分析方法來(lái)進(jìn)一步研究����。
表1.ADC和雙特異性抗體的PK定量方法(SCR�,標(biāo)準(zhǔn)曲線范圍;ECL��,電化學(xué)發(fā)光�;N.A.����,不適用)
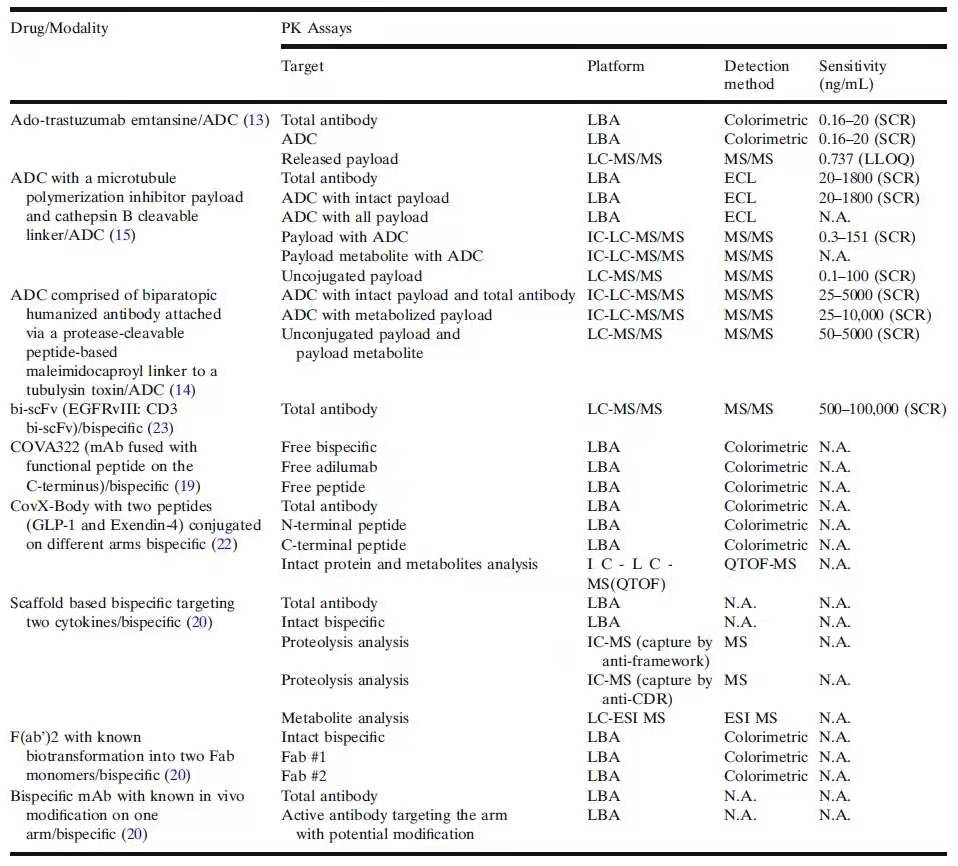 備注:表格中參考文獻(xiàn)的標(biāo)注不適用。
因此��,使用multiplexed PK/ADA方法以測(cè)定完整藥物、各種變構(gòu)體(variants)和相關(guān)的ADA是非常需要的�,同時(shí),也對(duì)潛在的生物轉(zhuǎn)化提供相關(guān)信息���。Multiplexed檢測(cè)方法已在聯(lián)合療法中有早期應(yīng)用���,但尚未看到對(duì)復(fù)雜藥物模式“biotransformation ready”的multiplexed測(cè)試方法,用以幫助評(píng)估復(fù)雜藥物的完整性����,表征各種生物轉(zhuǎn)化,并測(cè)試對(duì)藥物/藥物變構(gòu)體各部分的免疫反應(yīng)����。下文將簡(jiǎn)單介紹對(duì)復(fù)雜藥物模式有希望的兩項(xiàng)生物分析技術(shù):HR-MS定量分析完整蛋白質(zhì)和毛細(xì)管Western Blot定量分析。
HR-MS 定量分析完整蛋白質(zhì)
備注:表格中參考文獻(xiàn)的標(biāo)注不適用。
因此��,使用multiplexed PK/ADA方法以測(cè)定完整藥物、各種變構(gòu)體(variants)和相關(guān)的ADA是非常需要的�,同時(shí),也對(duì)潛在的生物轉(zhuǎn)化提供相關(guān)信息���。Multiplexed檢測(cè)方法已在聯(lián)合療法中有早期應(yīng)用���,但尚未看到對(duì)復(fù)雜藥物模式“biotransformation ready”的multiplexed測(cè)試方法,用以幫助評(píng)估復(fù)雜藥物的完整性����,表征各種生物轉(zhuǎn)化,并測(cè)試對(duì)藥物/藥物變構(gòu)體各部分的免疫反應(yīng)����。下文將簡(jiǎn)單介紹對(duì)復(fù)雜藥物模式有希望的兩項(xiàng)生物分析技術(shù):HR-MS定量分析完整蛋白質(zhì)和毛細(xì)管Western Blot定量分析。
HR-MS 定量分析完整蛋白質(zhì)
與針對(duì)完整藥物分子中某個(gè)選定區(qū)域的LBA和LC-MS/MS技術(shù)相比�����,完整蛋白質(zhì)的定量分析旨在將一個(gè)復(fù)雜的藥物分子作為一個(gè)整體來(lái)研究��,這能夠揭示重要的高層次結(jié)構(gòu)和生物轉(zhuǎn)化的相關(guān)信息�����。完整蛋白的LC-MS分析通常用作對(duì)生物轉(zhuǎn)化研究的定性分析。Murphy等人使用IC-LC Q-ToF MS����,在CovX-Body雙特異性抗體上發(fā)現(xiàn)并鑒別了蛋白酶剪切掉的含有8個(gè)氨基酸的肽段。He等人利用高分辨率的QTOF-MS與IC-LC相結(jié)合��,成功地在小鼠血漿中�,鑒別了若干不同DARs的ADC和生物轉(zhuǎn)化了的變異體(biotransformed variants,由于增加/刪除了hexose, glutathione, cysteine以及l(fā)inker-drug)��。近年來(lái)�����,HR-MS在靈敏度和質(zhì)量分辨率方面的提高�,逐漸使其在定量生物分析中得以有更廣泛的應(yīng)用。
Jian等人建立了IC-LC-QTOF-MS的工作流程��,用于小鼠血漿中人類mAbs的絕對(duì)定量��。定量的下限(LLOQ)為1000ng/mL(20 ?L血漿樣品)�����,并可降至250ng/mL�����,如果使用200?L樣品�。在優(yōu)化其數(shù)據(jù)處理策略后,LLOQ降至50ng/mL����。使用所述工作流程,Jian等人隨后展示了GLP1-Fc融合蛋白的定量���;同時(shí)���,在對(duì)小鼠的研究過(guò)程中,識(shí)別了該藥物的兩種主要蛋白酶降解產(chǎn)物��。
Lanshoeft等人驗(yàn)證了基于multiplex IC-LC-HRMS的PK定量方法�����,并用于非臨床PK研究�,該方法同時(shí)定量分析了大鼠血清中兩個(gè)人類IgG1。類似地����,Jin等人在大鼠血清中定量了完整的trastuzumab emtansine(一種ADC)及其主要的DAR物種��,其定量下限值約為20ng/mL����,線性動(dòng)態(tài)范圍為5-100?g/mL�。
另一個(gè)有趣的應(yīng)用是最近Zhang等人報(bào)道的,在非變性LC條件下對(duì)native intact mAb進(jìn)行的定量分析��,這可能為使用LC-HR-MS技術(shù)以multiplex的方式建立結(jié)合(bound)/未結(jié)合(unbound)PK定量方法以及其它各種功能域PK的定量方法提供了機(jī)會(huì)����。
毛細(xì)管Western Blot定量分析方法
毛細(xì)管Western blot,也稱為毛細(xì)管納米免疫測(cè)定(capillary nanoimmunoassay��,CNIA)����,已由制造商Protein Simple(San Jose, CA)商業(yè)化的Simple Western system,是指毛細(xì)管電泳免疫測(cè)定系統(tǒng)�,它提供基于蛋白質(zhì)大小和電荷的分離格式。與在分離和檢測(cè)之前進(jìn)行配體結(jié)合的IC-LC-MS技術(shù)不同�,Western blot首先分離蛋白質(zhì),然后使用配體結(jié)合作為檢測(cè)方法���。因此��,它能夠使用multiplexed immunoassay�,同時(shí)檢測(cè)完整的蛋白質(zhì)及其生物轉(zhuǎn)化的產(chǎn)物�����,并對(duì)變異的各種功能域進(jìn)行表征���。
目前���,毛細(xì)管Western Blot定量分析在蛋白質(zhì)藥物的PK研究中應(yīng)用仍然有限。Li等人在小鼠研究中驗(yàn)證了無(wú)濃縮的PK方法���,以定量小鼠血漿中的polyhistidine N-和FLAG C-terminally-tagged重組蛋白(約55kDa)���,其LLOQ為20ng/mL。Anti-FLAG tag抗體在immunoblot步驟中用作初級(jí)抗體���。研究發(fā)現(xiàn)����,只需以1:100至1:500的比例稀釋樣品���,即可消除基質(zhì)中高豐度蛋白的干擾���。
此外��,Kodani等人使用capillary western blot檢測(cè)到丙型肝炎病毒(HCV)的IgG抗體����,表明其在抗藥物抗體(ADA)檢測(cè)方面的潛在應(yīng)用�����。重組HCV蛋白首先在毛細(xì)管中分離和固定��。稀釋的人類血清隨后在毛細(xì)管中孵育���,使抗HCV抗體與固定的抗原結(jié)合����。這一步驟之后��,使用抗人類IgG-HRP抗體再進(jìn)行第二次孵育��。在70個(gè)特表征良好的人血清樣本的檢測(cè)中,該方法與另一種市售的抗HCV抗體測(cè)試方法的相關(guān)性良好����。
結(jié)論
為了解決雙特異性分子開(kāi)發(fā)過(guò)程中所需的生物分析支持,本文討論了在開(kāi)發(fā)這些藥物分子的PK分析策略時(shí)一些獨(dú)特的考慮����。本文提出的策略和方法可以應(yīng)用于雙特異性分子和其它多域大分子藥物����,這需要對(duì)特定的藥物分子其作用機(jī)制(MOA)和潛在的靶標(biāo)生物學(xué),以及評(píng)估PK/PD的所需要的數(shù)據(jù)有全面的了解�����。
大分子生物分析行業(yè)需要新的定量分析技術(shù)來(lái)開(kāi)發(fā)multiplexed PK定量方法�����,以便定量復(fù)雜模式的藥物及其生物轉(zhuǎn)化產(chǎn)物��。用于完整蛋白質(zhì)分析的(IC-)LC-HR-MS和capillary Western blot技術(shù)擁有很大應(yīng)用前景����,因其multiplexibility和提供目標(biāo)待測(cè)物的多維信息(如分子量等電點(diǎn)和域功能/domain functionality)的能力。在過(guò)去幾年中, HR-MS和capillary Western blot platforms的定量靈敏度有了顯著改善�,盡管這些技術(shù)仍需要進(jìn)一步改善,以獲得更廣泛的接受����。當(dāng)前HR-MS系統(tǒng)的一般操作相對(duì)簡(jiǎn)單,但HR-MS(以及capillary Western blot)的數(shù)據(jù)分析�、解釋和驗(yàn)證,從監(jiān)管的角度看�,還需要進(jìn)一步明確。
從理想的和雄心勃勃的角度思考����,最好將PK/PD/免疫原性/生物轉(zhuǎn)化的生物分析整合到一個(gè)分析測(cè)試方法之中,以減少藥物開(kāi)發(fā)所需的資源�����,并促進(jìn)在同一組患者樣本中全面闡明藥物的PK/PD行為�����。設(shè)計(jì)和開(kāi)發(fā)這樣的定量分析的方法��,對(duì)每一種生物藥結(jié)構(gòu)都是獨(dú)特的�,需要一種徹底的“適合其用途”的方法及其確認(rèn)(confirmation)�。為雙(多)特異性分子開(kāi)發(fā)可靠���、穩(wěn)健和可重現(xiàn)的PK分析方法是非常具有挑戰(zhàn)性的�,因?yàn)槎喾N因素會(huì)影響準(zhǔn)確(accurate)而有意義(meaningful)的濃度測(cè)定值��。未來(lái)生物分析行業(yè)和監(jiān)管機(jī)構(gòu)對(duì)指導(dǎo)定量分析這些高度復(fù)雜的生物(蛋白)藥的最佳做法的討論和意見(jiàn)�,將會(huì)極具價(jià)值。
未來(lái)前景
隨著生物分析方法的特異性��、選擇性和靈敏度的不斷提高���,更準(zhǔn)確(accurate)和更精密(precise)的測(cè)定雙特異性抗體濃度和評(píng)估其在生物樣品中的免疫原性將成為可能。預(yù)計(jì)雙特異性和多特異性生物藥的數(shù)量和種類將繼續(xù)擴(kuò)大���,這將促進(jìn)新的生物分析方法的開(kāi)發(fā)�,以適應(yīng)這些分子的結(jié)構(gòu)復(fù)雜性和MOAs���。
當(dāng)然��,目前的方法將被用于新的蛋白藥物的定量��。盡管LBA方法是目前生物分析方法的首要選擇���,并且在可以預(yù)見(jiàn)的未來(lái)仍將如此�,LC-MS/MS方法����,由于其與生俱來(lái)的multiplexed的定量分析能力,可能會(huì)得到更加廣泛地應(yīng)用��,以支持雙特異性生物藥的PK評(píng)估�����。LC-MS/MS比LBA分析具有更少的分析變異性(variability)和關(guān)鍵試劑的可及性(availability)問(wèn)題�。預(yù)期分析實(shí)驗(yàn)室的自動(dòng)化將擴(kuò)展到生物分析的所有階段,以減少人工錯(cuò)誤和提高數(shù)據(jù)質(zhì)量����。
特別聲明
本文如有疏漏和誤讀相關(guān)指南和數(shù)據(jù)的地方,請(qǐng)讀者評(píng)論和指正����。所有引用的原始信息和資料均來(lái)自已經(jīng)發(fā)表學(xué)術(shù)期刊、官方網(wǎng)絡(luò)報(bào)道等公開(kāi)渠道, 不涉及任何保密信息���。參考文獻(xiàn)的選擇考慮到多樣化但也不可能完備�。歡迎讀者提供有價(jià)值的文獻(xiàn)及其評(píng)估。
參 考 文 獻(xiàn)
1.Zhu, L, et al. (2020). "Bioanalytical Challenges in Support of Complex Modalities of Antibody-Based Therapeutics." AAPS J 22(6): 130.
2.Ma, M., et al. (2019). "Bioanalytical challenges and unique considerations to support pharmacokinetic characterization of bispecific biotherapeutics." Bioanalysis 11(5): 427-435.
3.Seimetz D. Novel monoclonal antibodies for cancer treatment: the trifunctional antibody catumaxomab (removab). J. Cancer 2, 309–316 (2011).
4.Mullard A. Bispecific antibody pipeline moves beyond oncology. Nat. Rev. Drug Discov. 16(11), 666–668 (2017).
5.Diao L, Meibohm B. Tools for predicting the PK/PD of therapeutic proteins. Expert Opin. Drug Metab. Toxicol. 11(7), 1115–1125 (2015).
6.Trivedi A, et al. Clinical pharmacology and translational aspects of bispecific antibodies. Clin. Transl. Sci. 10(3), 147–162 (2017).
7.Ezan E, et al. Assessment of the metabolism of therapeutic proteins and antibodies. Expert Opin. Drug Metab. Toxicol.10(8), 1079–1091 (2014).
8.Fischer SK, et al. The assay design used for measurement of therapeutic antibody concentrations can affect pharmacokinetic parameters. Case studies. MAbs 4(5), 623–631 (2012).
9.Ruf P, et al. Pharmacokinetics, immunogenicity and bioactivity of the therapeutic antibody catumaxomab intraperitoneally administered to cancer patients. Br. J. Clin. Pharmacol. 69(6), 617–625 (2010).
10.Samineni D, et al. Impact of shed/soluble targets on the PK/PD of approved therapeutic monoclonal antibodies. Exp. Rev. Clin. Pharm. 9(12), 1557–1569 (2016).
11.Villegas VM, et al. Current advances in the treatment of neovascular age-related macular degeneration. Expert Opin. Drug Deliv. 14(2), 273–282 (2017).
12.Ruppel J, et al. Preexisting antibodies to an F(ab’)2 antibody therapeutic and novel method for immunogenicity assessment. J. Immunol. Res. 2016, 1–8 (2016).
13.Fan X, et al. Lens glutathione homeostasis: discrepancies and gaps in knowledge standing in the way of novel therapeutic approaches. Exp. Eye Res. 156, 103–111 (2017).
14.Kang L, et al. LC-MS bioanalysis of intact proteins and peptides. Biomed Chromatogr. 2020;34(1):e4633. https://doi.org/10.1002/bmc.4633.
15.Chen, J, et al. "Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics." Journal of translational medicine 13: 182. (2015)
16.Murphy RE, et al. Combined use of immunoassay and twodimensional liquid chromatography mass spectrometry for the detection and identification of metabolites from biotherapeutic pharmacokinetic samples. J Pharmaceut Biomed.2010;53(3):221–7. https://doi.org/10.1016/j.jpba.2010.04.028.
17.He JT, et al. High resolution accurate-mass mass spectrometry enabling in-depth characterization of in vivo biotransformations for intact antibody-drug conjugates. Anal Chem. 2017;89(10):5476–83.https://doi.org/10.1021/acs.analchem.7b00408.
18.Jian WY, et al. A workflow for absolute quantitation of large therapeutic proteins in biological samples at intact level using LC-HRMS. Bioanalysis.2016;8(16):1679–91. https://doi.org/10.4155/bio-2016-0096.
19.Lanshoeft C, et al. Generic hybrid ligand binding assay liquid chromatography high resolution mass spectrometry based workflow for multiplexed human immunoglobulin G1 quantification at the intact protein level: application to preclinical pharmacokinetic studies. Anal Chem. 2017;89(4):2628–35. https://doi.org/10.1021/acs.analchem.6b04997.
20.Jin W, et al. LC-HRMS quantitation of intact antibody drug conjugate trastuzumab emtansine from rat plasma. Bioanalysis. 2018;10(11):851–62. https://doi.org/10.4155/bio-2018-0003.
21.Zhang LY, et al. Top-down LC-MS quantitation of intact denatured and native monoclonal antibodies in biological samples. Bioanalysis. 2018;10(13):1039–54. https://doi.org/10.4155/bio-2017-0282.
22.Li Y, et al. An efficient and quantitative assay for epitope-tagged therapeutic protein development with a capillary western system. Bioanalysis. 2019;11(6):471–84. https://doi.org/10.4155/bio-2018-0248.
23.Kodani M, et al. An automated immunoblot method for detection of IgG antibodies to hepatitis C virus: a potential supplemental antibody confirmatory assay. J Clin Microbiol. 2019;57(3). https://doi.org/10.1128/JCM.01567-18.
關(guān)于博濟(jì)醫(yī)藥 臨床研究服務(wù):
博濟(jì)醫(yī)藥擁有一支規(guī)模龐大�、專業(yè)成熟的臨床研究隊(duì)伍,可提供包括醫(yī)學(xué)�����、項(xiàng)目管理�����、監(jiān)查��、稽查���、數(shù)據(jù)管理和統(tǒng)計(jì)分析�、生物樣本檢測(cè)在內(nèi)的臨床試驗(yàn)全流程解決方案��。截至2020年��,博濟(jì)醫(yī)藥服務(wù)的客戶超1000家����,完成800多項(xiàng)臨床試驗(yàn)項(xiàng)目�����,助力客戶獲得新藥證書(shū)60多項(xiàng)、生產(chǎn)批件超過(guò)80項(xiàng)��。擁有豐富的臨床試驗(yàn)服務(wù)經(jīng)驗(yàn)���,服務(wù)項(xiàng)目涵蓋臨床研究各個(gè)領(lǐng)域���,在腫瘤、肝病�、消化等創(chuàng)新藥領(lǐng)域擁有獨(dú)特的臨床服務(wù)體系。
博濟(jì)醫(yī)藥在全國(guó)設(shè)有40多個(gè)臨床監(jiān)查網(wǎng)點(diǎn)�����,與全國(guó)近600個(gè)臨床試驗(yàn)機(jī)構(gòu)展開(kāi)合作��,并運(yùn)用ORACLE OC/RDC及CTMS系統(tǒng)���,控制臨床數(shù)據(jù)采集的及時(shí)性���、管理臨床試驗(yàn)過(guò)程的規(guī)范性。





























